Στις πανελλήνιες εξετάσεις των
ημερήσιων Γενικών Λυκείων στο μάθημα της Χημείας οι μαθητές εξετάστηκαν και σε
ένα θέμα που αφορούσε μια ογκομέτρηση υδατικού δ/τος άλατος. Η άσκηση (
ογκομέτρηση υδατικού δ/τος HCOONa με
πρότυπο υδατικό δ/μα HCl
) ήταν μια οξυμετρία στην οποία τη καμπύλη ογκομέτρησης και το ισοδύναμο σημείο
ήταν μέρος των δεδομένων της.
Στην συνέχεια ζητήθηκε να επιλεγεί ο καλύτερος δείκτης για την
εύρεση του τελικού σημείου της ογκομέτρησης ( εννοούσε το ισοδύναμο σημείο της ογκομέτρησης
) ανάμεσα από τέσσερις (4) προτεινόμενους δείκτες.
Το ιδιαίτερο ( που προέκυψε ) για την συγκεκριμένη ογκομέτρηση δεν είναι για μένα το
γεγονός ότι ογκομετρείται υδατικό δ/μα άλατος αλλά ότι ογκομετρείται υδατικό
δ/μα τόσο ασθενούς ηλεκτρολύτη ( το ιόν HCOO- το
οποίο ογκομετρείται είναι βάση κατά Bronsted – Lowry με σταθερά Kb=10-10 σύμφωνα με τα
δεδομένα της άσκησης ).
Το θέμα συζήτησης προκλήθηκε ύστερα από παρέμβαση του συνάδελφου Αντώνη Παπαστεργίου στο ylikonet.gr
Το θέμα – ΙΜΟ - έχει ιδιαίτερο ενδιαφέρον όχι τόσο από «εξεταστικοκεντρική» άποψη ή από άποψη θεματοδοσίας όσο από την επιστημονική γνώση που πηγάζει μέσα από αυτό. ( τουλάχιστον για εμένα ).
Οι μαθητές δεν αντιλήφθηκαν τίποτα τα παρακάτω ( εκτιμώ ότι ούτε και εμείς) και έλυσαν την άσκηση χωρίς προβλήματα ή τέλος πάντων χωρίς βαθμολογικό κόστος που θα μπορούσε να προκύψει από τις ιδιομορφίες της συγκεκριμένης ογκομέτρησης. Για τους μαθητές το ισοδύναμο σημείο της ογκομέτρησης ήταν δοσμένο τόσο γραφικά όσο και ονομαστικά.
Το θέμα μας είναι με ποιόν τρόπο αυτά τα δεδομένα θα μπορούσαν ( ή
δεν θα μπορούσαν ) να είναι πειραματικά ευρήματα.
Η έντυπη βιβλιογραφία που έχω γράφει στο βιβλίο του Καθηγητή Βασιλικιώτη
Γ.Α. ( 1980 ανατύπωση 1991-92 ) «Αναλυτική Χημεία - Ποσοτική ανάλυση – Τεύχος
Β» ,ΑΠΘ , Θεσσαλονικη 1991
Ο καθηγητής Βασιλικιώτης αναφέρει ότι η ογκομέτρηση δεν μπορεί να
γίνει σε δ/τα πολύ ασθενών ηλεκτρολυτών γιατί η μεταβολή στο ισοδύναμο σημείο δεν
είναι απότομη και δεν μπορεί να ανιχνευτεί.
Στο βιβλίο του Καθηγητή Αλεξιάδη Κ.Α ( 1981 ) "Αναλυτική
Χημεία - Α' Χημική Ισορροπία" ΑΠΘ, Θεσσαλονικη 1991 για το Τμήμα των
Χημικών Μηχανικών επισημαίνεται το ίδιο πρόβλημα ( έλλειψη απότομης μεταβολής της
καμπύλης της ογκομέτρησης )
και προτείνεται η χρήση «μικτών δεικτών» ( δηλαδή συνδυασμού
δεικτών ) που αλλάζουν χρώμα σε μια καθορισμένη τιμή pH και όχι σε
μια καθορισμένη περιοχή pH.
Μέχρι πόσο όμως ασθενής μπορεί να
είναι ένας ηλεκτρολύτης ώστε να μπορεί ένα δ/μα του να μπορεί να τιτλοδοτηθεί
με οξεοβασική ογκομέτρηση ;
Στις παρακάτω σημειώσεις περί υδατικών
δ/των ( πρέπει να είναι από το ΕΜΠ – Μεταλλειολόγοι )
γράφεται :
«Γενικά
σημεία ισοδυναμίας που αντιστοιχούν σε ιονισμό οξέων ή βάσεων με σταθερά ιονισμού
μικρότερη από 10-8 δεν είναι δυνατόν να ανιχνευθούν με τιτλοδότηση»
Ενώ στις σημειώσεις περί οξεοβασικής
ογκομέτρησης του τμήματος Βιοχημείας και Βιοτεχνολογίας του Πανεπιστημίου
Θεσσαλίας
αναφέρεται ότι :
- · Έτσι η ελάχιστη ελάχιστη συγκέντρωση συγκέντρωση ισχυρού ηλεκτρολύτη που μπορεί να ογκομετρηθεί ογκομετρηθεί με ακρίβεια ακρίβεια είναι 5x10-4 M
- · Έχει υπολογιστεί ότι η ελάχιστη συγκέντρωση ασθενούς οξέος που μπορεί να ογκομετρηθεί με ακρίβεια είναι 10-6 M
- ·
Για να είναι επιτυχής επιτυχής μια ογκομέτρηση
ογκομέτρηση θα πρέπει το γινόμενο γινόμενο
Ka·C να
μηνυπερβαίνει την τιμή 10-9
Προσπάθησα να προσομοιώσω δύο
ογκομετρήσεις υδατικών δ/των αλάτων ασθενών μονοπρωτικών οξέων μέσω του Irydium http://chemcollective.org/vlabs και νομίζω ότι έχουν ενδιαφέρον μερικές
παρατηρήσεις.
1Η
περίπτωση – Ογκομέτρηση 20 mL
υδατικού
δ/τος CH3COONa συγκέντρωσης 0,2 Μ με πρότυπο υδατικό
δ/μα HCl συγκέντρωσης
0,2 Μ.
Θερμοκρασία : 25οC
Σταθερές :
Ka= 1,74·10-5 και για την συζυγή μορφή HCOO- που ογκομετρείται Kb=5,74·10-10
Γινόμενο K·c = 1,15·10-10
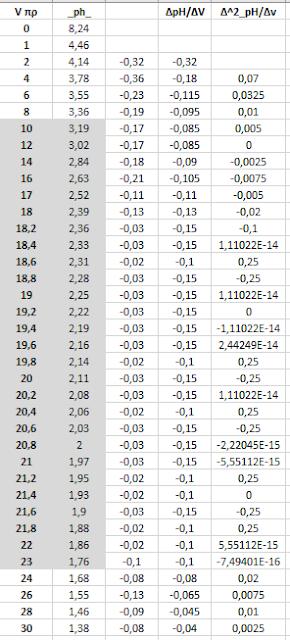
Τιμές ογκομέτρησης
Καμπύλη ογκομέτρησης :
Προφανώς δεν είναι εύκολο να διαπιστωθεί το ισοδύναμο σημείο της ογκομέτρησης
.
Με την χρήση όμως της 1ης παραγώγου το ισοδύναμο σημείο
αποκαλύπτεται πολύ εύκολα.
Κάτι που επιβεβαιώνει και η 2η παράγωγος :
Αυτό φανερώνει ότι η ογκομέτρηση ενός υδατικού δ/τος άλατος
ασθενούς μονοπρωτικού οξέος είναι εφικτή , αρκεί :
-
Να μην χρησιμοποιηθεί για την εύρεση του ΙΣ άμεσα
η καμπύλη τιτλοδότησης ( δηλαδή η παράσταση pH – Vπροτύπου )
-
Να χρησιμοποιηθεί η 1η ( ή και η 2η
παράγωγος ) της μεταβολής του pH
συναρτήσει
του προστιθέμενου όγκου προτύπου .
-
Να μην χρησιμοποιηθεί ένας πρωτολυτικός δείκτης
( όχι συνδυασμός δεικτών ) μιας που το εύρος της προσθήκης πρότυπου δ/τος που
απαιτείται για την χρωματική μεταβολή είναι απαγορευτικό [ Για παράδειγμα εάν
χρησιμοποιήσουμε την κατάλληλη επιλογή του δείκτη των πανελληνίων 2018 το «Κυανούν
της θυμόλης ( 1,7 - 3,2 )» χρειάζεται 5,5 mL για να αλλάξει πλήρως το χρώμα του (
στο συγκεκριμένο παράδειγμα ) ]
Βλέπουμε ότι ακόμα και στο γινόμενο K·c = 10-10
η ογκομέτρηση μπορεί να μην δίνει καμπύλη ογκομέτρησης με ευδιάκριτο το ισοδύναμο
σημείο ωστόσο με την χρήση των παραγώγων της μεταβολή του pH μπορούμε να το βρούμε σχετικά εύκολα.
2Η
περίπτωση – Ογκομέτρηση 20 mL
υδατικού
δ/τος NaF συγκέντρωσης
0,2 Μ με πρότυπο υδατικό δ/μα HCl
συγκέντρωσης
0,2 Μ.
Θερμοκρασία : 25οC
Σταθερές :
Ka= 6,6·10-4 και για την συζυγή μορφή HCOO- που ογκομετρείται Kb=1,51·10-11
Γινόμενο K·c = 3·10-12
Τιμές ογκομέτρησης
Καμπύλη ογκομέτρησης
1η παράγωγος
2η παράγωγος
Είναι φανερό ότι στην περίπτωση αυτή
ούτε η 1η αλλά ούτε και η 2η παράγωγος μπορούν να
οδηγήσουν σε συμπεράσματα οπότε επαληθεύεται ( ίσως με το πιο αυστηρό κριτήριο ) η
εκτίμηση ότι δεν μπορούν όλα τα διαλύματα οξέων ή βάσεων να τιτλοδοτηθούν με οξεοβασική
ογκομέτρηση.
( Αξίζει να προσεχθεί ότι η μεταβολή
του χρώματος του κατάλληλου δείκτη είναι 13 mL !!! )
Να σημειωθεί εδώ ότι τα παραπάνω αποτελέσματα προκύπτουν από ηλεκτρονική προσομοίωση ογκομέτρησης ( δηλαδή μηχανές ) όπου το πεχάμετρο έχει ακρίβεια μέχρι 2ο δεκαδικό ψηφίο. Εάν στις μετρήσεις εισάγουμε και τον ανθρώπινο παράγοντα εύκολα καταλαβαίνουμε ότι το κριτήριο του γινομένου K·c > 10-9 είναι πιο ρεαλιστικό και πολύ πιο κοντά στην πραγματικότητα ενός χημικού εργαστηρίου.













Κυριε Μπαλτζοπουλε συγχαρητηρια για το το πληρες και 'ζουμεροτατο' αρθρο. Πολυ ολοκληρωμενη προσεγγιση.
ΑπάντησηΔιαγραφήΕυχαριστώ κ. Κουτσομπογέρα. Χαίρομαι που σας άρεσε. Βέβαια βοήθησε και το θέμα που είχε - εκτιμώ - ιδιαίτερο ενδιαφέρον. Τελικά η οξεοβασική ογκομέτρηση έχει δεν έχει απεριόριστες δυνατότητες.
ΑπάντησηΔιαγραφήΕξαιρετική ποιοτική περιεκτικότατη κατανοητή ανάλυση.. Κλασικός Μπαλτζόπουλος :)
ΑπάντησηΔιαγραφήCongrats :)
Anthony Baltzo23 Ιουνίου 2018 - 7:22 μ.μ.
ΑπάντησηΔιαγραφήΚαλησπέρα Βασίλη . Ευχαριστώ για το σχόλιο. Δεν κρύβω ότι "πέθανες" με αυτό το "κλασικός".
Όπως έγραψα και παραπάνω φαίνεται ότι η ογκομέτρηση έχει τα όρια της. Το γινόμενο K*c ως κριτήριο μου φαίνεται πιο πλήρες και έχω την αίσθηση ότι συνδέεται με την διακριτική ικανότητα των πεχά-μετρων που μετρούν έως δεύτερο δεκαδικό ( όχι τρίτο ).
Και πάλι ευχαριστώ.
Ελπίζω να σου λείπει ένα "με" στην 3η πρόταση :P
ΑπάντησηΔιαγραφήΤο σίγουρο είναι ότι αν τα θέματα των εξετάσεων τείνουν να τοποθετηθούν σε άλλη τροχιά σιγά σιγά, χρειάζεται πολλή προσοχή και μελέτη από τις επιτροπές γιατί οι εξυπναδίτσες από τις ανακρίβειες απέχουν τελικά ελάχιστα..
Ευχαριστούμε εμείς για την ανάλυση Αντώνη..
..."με πέθανες" όντως.
ΑπάντησηΔιαγραφήΜ'άρεσε αυτό το "...οι εξυπναδίτσες από τις ανακρίβειες απέχουν τελικά ελάχιστα..." και θα το κρατήσω.
Το έργο της θεματοδοσίας των πανελληνίων είναι εξαιρετικά δύσκολο ( γράφω ένα διαγώνισμα, το λύνω 2 φορές, βρίσκω 10 λάθη, το στέλνω σε 5 συναδέλφους, βρίσκουν άλλα 10 , το δίνω ήρεμος στους μαθητές ... βρίσκουν άλλα 2 !!!) και θέλει πολύ προσοχή εάν θέλεις να κινηθείς διαφορετικά.
Με δεδομένο ότι δεν επιτρέπεται τα θέματα να έρχονται έτοιμα στο Υπουργείο φοβάμαι ότι μπορεί να δούμε πολλές "εξυπναδίτσες" γεμάτες "ανακρίβιες" ή ( να προσθέσω και εγώ κάτι ) "μερικές γενικευσεις".